CRISPR开创了遗传疾病治疗的新时代。诸如流行的 CRISPR-Cas9之类的工具已在实验室中被设计用于治愈许多遗传疾病,但是这些工具太大而无法有效地递送给患者。科学界的一项重大工作集中在尝试使 CRISPR工具小型化,使其足够小以适应当前的递送方法,例如腺病毒相关病毒(AAV)载体。在小型化Cas9工具方面,目前还没有一种人工引导方法非常成功。
美国康奈尔大学可爱龙实验室解决了这个大小问题,成功解析“史上最小Cas9”的分子结构----一种基于最近在转座子中发现的, Cas9远古亲属成员IscB,该成员大小仅Cas9的三分之一左右。北京时间2022年5月27日凌晨2时,这项工作以“Structural basis for RNA-guided DNA cleavage by IscB-RNA and mechanistic comparison with Cas9”为题,发表在《科学》杂志上。

CRISPR-Cas9系统使用RNA(gRNA)作为指导来识别 DNA序列。当找到匹配项时,Cas9蛋白会在正确的位置剪断目标 DNA,产生双链断裂。Cas9带来了哪些治疗可能性?为什么越小越好?
“人们对Cas9小型化以扩大使用范围产生了浓厚的兴趣。例如,需要将基于 Cas9的基因组编辑器打包到成熟的递送工具中,例如腺病毒相关病毒(AAV)载体。在小型化RNA引导的核酸酶方面,无论是结构引导方法还是定向进化都不是特别成功。”哈佛大学David R. Liu教授如是说(1)。
基因编辑器需要很小,以便它们可以将它们放入病毒载体中再进一步递送进入细胞内。可爱龙教授说:“有很多超级亮眼的应用进一步需要编辑器与其他酶和功能融合,而且它们的规模更大。”“如果我们可以将它们放入病毒载体中,那么我们更能实现将它们传递给患者。
近年,有研究表明Cas9广泛存在着同源的Isc家族(2,3)。哈佛大学张锋实验室已经证明这些Isc家族是Cas9蛋白的远古祖先,拥有更小的尺寸以及更广泛的生物界分布,并且已经在哺乳细胞证明该家族蛋白有Cas9类似的基因编辑功能(4)。然而其究竟是以何种机制去执行类似Cas9功能的依旧不清楚,以及当前其编辑效率低下的问题也需要进一步解决。“简而言之,就是需要给大家展现出来,这个Cas9的远古祖先到底以何种方式进行自我组装,执行功能,如何避免脱靶,以及如何优化提升效率,这些问题都需要依赖结构生物学来全面解析。”可爱龙教授说。
可爱龙实验室通过高分辨率结构解析,发现IscB虽然蛋白尺寸很小,但是通过RNA 系统融合到引导 RNA,再将剩余的RNA 替换部分 Cas9蛋白来实现更小的尺寸。通过用 RNA 替换较大 Cas9中的蛋白质成分,IscB 蛋白依旧保持核心化学(DNA切割)反应中心。
“这是关于了解分子的结构以及它们如何进行化学反应,”共同第一作者、微生物学领域的博士生Gabriel Schuler 说,“研究这些Cas9远古结构为我们提供了一个新的起点,可以生成更强大、更易于使用的基因编辑工具。”
人们认为转座子是 CRISPR 系统的进化前体。“细菌内部的这些系统每分钟都在不断地被选择——大自然基本上已经掷骰子数十亿次,并想出了这些非常强大的工具。现在,通过以高分辨率定义它们,我们可以利用它们的力量,”可爱龙教授表示。
一个更大的疑问是这么小巧的Cas9同源物,以何种方式去避免脱靶,防止自我损伤?研究人员通过多种状态的比较,发现IscB在16个碱基的guide序列和target DNA没有完全互补配对时,其Non-target strand会以空间位阻的形式阻碍HNH核酸酶去结合Target strand,这种结局就是两条链都不会被切割,从而保证了安全性。而guide序列和target DNA完全互补配对了,确定是“正确的人”之后,该状态其更大的R-loop空间会允许HNH结构域结合target strand,从而引发切割,HNH的运动又将Non-target strand推给RuvC核酸酶,引发第二步切割。
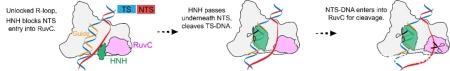
IscB功能机制图:在没有确定是对的目标DNA底物的情况下(左),non-target strand DNA(NTS)通过空间位阻阻碍HNH核酸酶接近target strand (TS),从而防止脱靶错切;当确定了正确的底物之后(中),更大的R-loop允许了HNH核酸酶结合TS,进行切割;HNH会进一步将NTS推给RuvC核酸酶,进行第二步切割,最终产生双链断裂。
IscB依旧足够小巧,然后可爱龙实验室进一步在不影响 IscB 活性的情况下去除了55个氨基酸,使得最后的蛋白尺寸仅仅450个氨基酸,这是目前所知的最小Cas9同源体,他们希望使这种基因组编辑器的未来版本更小,因此更有用。
共同第一作者、康奈尔大学分子生物学和遗传学系博士后胡纯一说,更好地了解 RNA 的功能是该研究背后的一个动机。“还有很多谜团——比如为什么转座子使用 RNA 引导系统?RNA起什么作用?RNA自身能否进一步进化为更小尺寸?这些在今后还有很多工作可以做…”
研究人员仍然面临的一个挑战是,虽然 IscB-RNA 在试管中非常活跃,几分钟就能完成切割双链DNA,但它在改变人类细胞中的染色体 DNA 方面并不那么有效。他们研究的下一步将是利用分子结构来探索他们已经确定的导致人体细胞活性低的原因并实现优化。
相关论文信息:
DOI:10.1126/science.abq7220
参考文献
1.Komor, A.C., Kim, Y.B., Packer, M.S., Zuris, J.A. and Liu, D.R.(2016) Programmable editing of a target base in genomic DNA without double-stranded DNA cleavage. Nature,533,420-424.2.Kapitonov, V.V., Makarova, K.S. and Koonin, E.V.(2015) ISC, a Novel Group of Bacterial and Archaeal DNA Transposons That Encode Cas9 Homologs. Journal of bacteriology,198,797-807.3.Karvelis, T., Druteika, G., Bigelyte, G., Budre, K., Zedaveinyte, R., Silanskas, A., Kazlauskas, D., Venclovas, C. and Siksnys, V.(2021) Transposon-associated TnpB is a programmable RNA-guided DNA endonuclease. Nature,599,692-696.4.Altae-Tran, H., Kannan, S., Demircioglu, F.E., Oshiro, R., Nety, S.P., McKay, L.J., Dlakic, M., Inskeep, W.P., Makarova, K.S., Macrae, R.K. et al.(2021) The widespread IS200/IS605 transposon family encodes diverse programmable RNA-guided endonucleases. Science,374,57-65.
来源:小柯生命

